HIDRÓXIDOS
<HIDRÓXIDOS>
¿Qué es un hidróxidos?
Los hidróxidos son un grupo de compuestos químicos formados por un metal y el grupo funcional OH,(ión hidróxido, OH-), denominado grupo hidróxido o hidroxilo, que actúa con número de oxidación -1.
El hidróxido, combinación que deriva del agua por sustitución de uno de sus átomos de hidrógeno por un metal, está presente en muchas bases.
Antiguamente a los hidróxidos de los alcalinos y del amonio se los conocía con el nombre de álcalis, pero este término tras la implantación de la nomenclatura moderna se usa más para denominar a cualquier sustancia que presenta carácter alcalino.
Usos de los hidróxidos
El hidróxido de magnesio es bien conocido como antiácido, muchos digestivos estomacales lo incluyen en su formulación. A mayores concentraciones tiene poder laxante.
El hidróxido de aluminio también se emplea como antiácido en las denominadas sales de fruta. El hidróxido de calcio es muy utilizado en la construcción, se lo conoce en ese ámbito como cal apagada.
Las ecuaciones
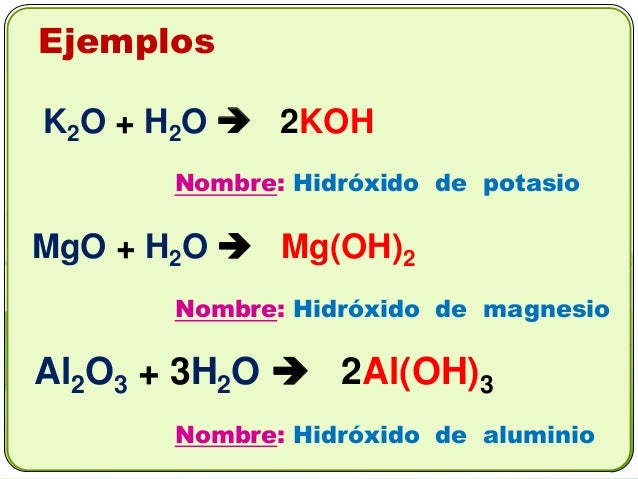
Los hidróxidos se formulan escribiendo el metal seguido del grupo dependiente con la base de un ion de radical adecuado con hidroxilo; éste va entre paréntesis si el subíndice es mayor de uno. Se nombran utilizando la palabra hidróxido seguida del nombre del metal, con indicación de su valencia, si tuviera más de una. Por ejemplo, el Ni(OH)2 es el hidróxido de níquel (II) y el Ca(OH)2 es el hidróxido de calcio (véase Nomenclatura Química).
Las disoluciones acuosas de los hidróxidos tienen carácter básico, ya que éstos se disocian en el catión metálico y los iones hidróxido. Esto es así porque el enlace entre el metal y el grupo hidróxido es de tipo iónico, mientras que el enlace entre el oxígeno y el hidrógeno es covalente.Por ejemplo:
- NaOH(aq) → Na+(aq) + OH-
Los hidróxidos resultan de la combinación de un óxido básico con el agua. Los hidróxidos también se conocen con el nombre de bases. Estos compuestos son sustancias que en solución producen iones hidroxilo.
Ejemplos
- Nomenclatura Tradicional: "Hidróxido" + prefijo / sufijo según la valencia del metal (hipo-, -oso, -ico, per-):
- Cr(OH)2: hidróxido hipocromoso (posee 3 valencias y actúa con la menor)
- Cr(OH)3: hidróxido cromoso (posee 3 valencias y actúa con la mediana)
- Cr(OH)6: hidróxido cromico (posee 3 valencias y actúa con la mayor)
- V(OH)2: hidróxido hipovanadoso (posee 4 valencias y actúa con la menor)
- V(OH)3: hidróxido vanadoso (posee 4 valencias y actúa con la segunda menor)
- V(OH)4: hidróxido vanádico (posee 4 valencias y actúa con la segunda mayor)
- V(OH)5: hidróxido pervanádico (posee 4 valencias y actúa con la mayor)
- Nomenclatura Sistemática: prefijo del nº de aniones (OH)- + "hidróxido de" + metal
- Be(OH)2: dihidróxido de berilio
- Fe(OH)2: dihidróxido de hierro
- Fe(OH)3: trihidróxido de hierro
- Nomenclatura de Stock: "hidróxido de" + elemento + valencia en números romanos y entre paréntesis:
- Fe(OH)2: hidróxido de hierro (II)
- Fe(OH)3: hidróxido de hierro (III)
- HgOH: hidróxido de mercurio (I)
- Be(OH)2: hidróxido de berilio → al tener solo una valencia no se indica

Comentarios
Publicar un comentario